 |
English
日本語
|
 |
日本語 English |
|
|
|
研究活動
新規免疫治療剤HVJ-Eの開発と臨床応用
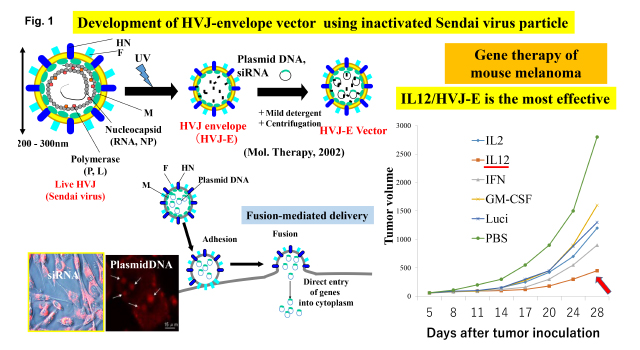
センダイウイルスは1950年代にわが国で発見されたマウス肺炎ウイルスでヒトへの病原性はない。細胞融合を起こすウイルスとして注目されてきた。約15kBのRNAを含む、約200~300 nmの粒子であり、その受容体は酸性のガングリオシドである。我々は、このウイルスを紫外線で不活性化し、その不活性化粒子をもとにし遺伝子やsiRNAを導入できるベクターであるHVJ envelope vector (HVJ-E)を開発した(Fig.1)。このベクターにより、様々な培養細胞や組織細胞への遺伝子導入やドラッグデリバリーが可能になった。膜融合により直接細胞質内への導入が可能である。
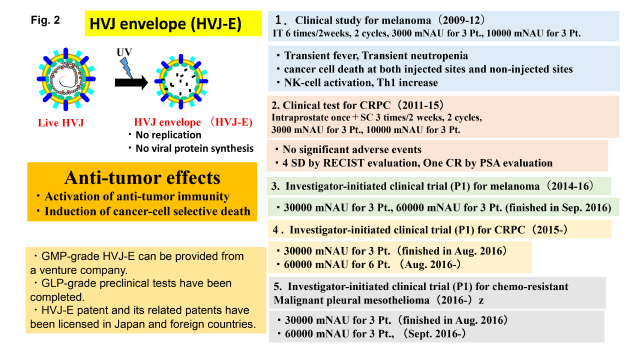
近年、我々は、HVJ-E ベクターそれ自身に抗腫瘍効果をもつことを見出した(Fig. 2)。HVJ-Eはウイルスゲノムの複製能もウイルス蛋白質の産生能も喪失しているが、治療分子を封入しなくても多彩な抗腫瘍活性を発揮する。その1つは、抗腫瘍免疫の活性化、もう1つは癌細胞選択的細胞死誘導である。この分子機構の解明は、腫瘍細胞の特性の解明につながり、ひいてはがん制圧の新たな戦略を提唱できるものである。臨床用のHVJ-Eは大阪大学発ベンチャーのジェノミディア社で生産されており、GLPの非臨床研究を終了した。
HVJ-Eを用いた臨床研究は大阪大学医学部附属病院でメラノーマデ行われ、2012年に終了した。2011年より、去勢抵抗性前立腺癌を対象として臨床試験が行われ2015年に終了した。その結果を基に、メラノーマの第一相医師主導治験が実施され2016年9月に終了した。現在、去勢抵抗性前立腺癌と化学療法抵抗性悪性胸膜中皮腫の第一相医師主導治験が行われている(Fig. 2)。
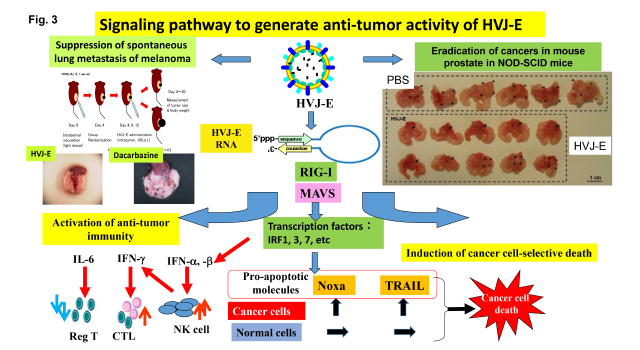
1) 多彩な抗腫瘍免疫の活性化機構 (Fig. 3)
HVJ-Eは腫瘍細胞や樹状細胞、マクロファージなどからのケモカイン産生誘導によって、NK細胞やCD4+, CD8+ T cellを腫瘍巣に引き寄せ、Th1優位な形質転換を誘導し、NK細胞やEffector T cellの抗腫瘍効果を高めることが分かってきた(Cancer Res. 2007)。さらにこれらT細胞免疫を抑制する制御性T細胞をIL-6の分泌を介して抑制し(FEBS Lett. 2008)、最終的に抗腫瘍活性を高め維持することができる。この抗腫瘍免疫には、腫瘍微小環境のマクロファージや好中球にHVJ-Eが作用して、腫瘍促進生の細胞を抗腫瘍性に形質転換し、それらがeffector T cellの遺伝子発現をコントロールし、腫瘍細胞傷害性T細胞としての機能を高めることがわかってきた(Oncotarget 2016)。現在、免疫チェックポイントに対する抗体療法が癌治療に用いられ有望な結果が得られているが、この治療法に抵抗性の癌に対して、作用機序の異なるHVJ-Eは抗腫瘍効果を補完できる可能性が高い。現在、さらに抗腫瘍効果を増強できるシグナル経路の探索とその新たな制御機構の研究を進めている。その成果をもとに今後はHVJ-Eを用いた新たな癌遺伝子治療の開発を行う。
2) 癌細胞選択的な細胞死誘導 (Fig. 3)
HVJ-Eは前立腺癌やグリオーマなどのヒト癌に対して選択的な細胞死を誘導する。HVJの受容体のgangliosideは多くの癌細胞で高発現が認められ(Int. J. Cancer 2010)、このレセプターを発現した癌細胞は、HVJ-Eのみで細胞死が誘導される。正常細胞も受容体を発現しているが細胞死は誘導されない。そのメカニズムはウイルスRNAゲノム断片が細胞内核酸受容体によって認識されて活性化されるシグナルによる癌細胞選択的なアポトーシス誘導であることがわかった(Clinical Cancer Res. 2012)。我々は最近その構造を明らかにしている(Mol. Therapy 2016)。しかしCaspase 8の欠損した神経芽腫細胞では細胞融合時の細胞質内カルシウムの上昇によってCaM-kinase IIが活性化されプログラム化されたNecroptosisが起こることを発見した(Cancer Res. 2015)。現在は、アポトーシス誘導因子の発現が何故癌細胞選択的に発現するのか、それら遺伝子のエピゲノム状態はどのようになっているのかを解明している。また最近注目されているゲノム編集法であるCRISPR/Cas9を用いて、網羅的に遺伝子をノックアウトしてHVJ-Eに抵抗性の癌細胞を分離して、癌細胞死に関与している遺伝子の全貌を明らかにしようとしている。
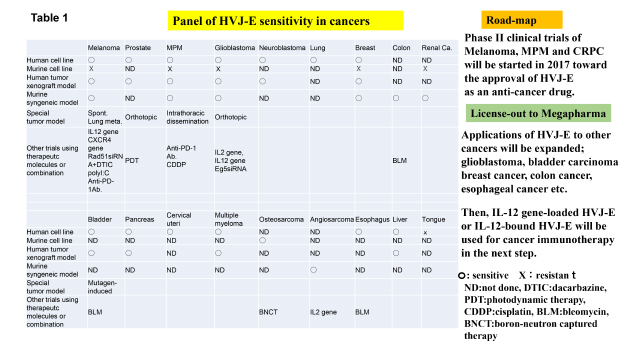
Table 1に示しように、ほとんどの癌種がHVJ-Eの標的になりうる。現在行っているメラノーマ、前立腺癌、悪性胸膜中皮腫については、2017年に第二相の治験を実施予定であり、薬事申請を目指している。他の癌(膠芽腫、膀胱癌、乳癌、食道癌、結腸癌など)もすでに非臨床研究で成果が得られており、これらの癌についても臨床応用を計画している。一方、HVJ-EにIL-12遺伝子を封入したベクターは、マウスメラノーマに対して高い治療効果を示しており、遺伝子治療も計画している。この結果をもとに、IL-12分子をまく表面意もつ全身投与方の高機能化HVJ-Eも開発しており(Clin. Cancer Res. 2013), 将来は全身投与による多発性転移癌も対照とした臨床応用を目指す予定である。
今後、国際共同研究や国際共同治験も行いたいと考えておりパートナーを募集している。連絡先は以下のとおり。
教授
大阪大学大学院医学系研究科
遺伝子治療学
e-mail:kaneday@gts.med.osaka-u.ac.jp
代表取締役 社長
ジェノミディア株式会社
e-mail: to-nakajima@iskweb.co.jp


-
2025年11月27日
難治性炎症性疾患の発症を抑制する遺伝子タイプの同定 -
2025年11月27日
パーキンソン病にiPS細胞投与の治療法承認 -
2025年11月27日
遺伝子治療の効率化に新しい方法 -
2025年11月27日
血管新生を利用した閉塞性動脈疾患の治療 -
2025年11月27日
遺伝子導入による小児神経変性疾患の治療研究 -
2025年8月28日
第3回日本ウイルス療法学会学術集会が 2025年11月8日(土)に開催されます。











